

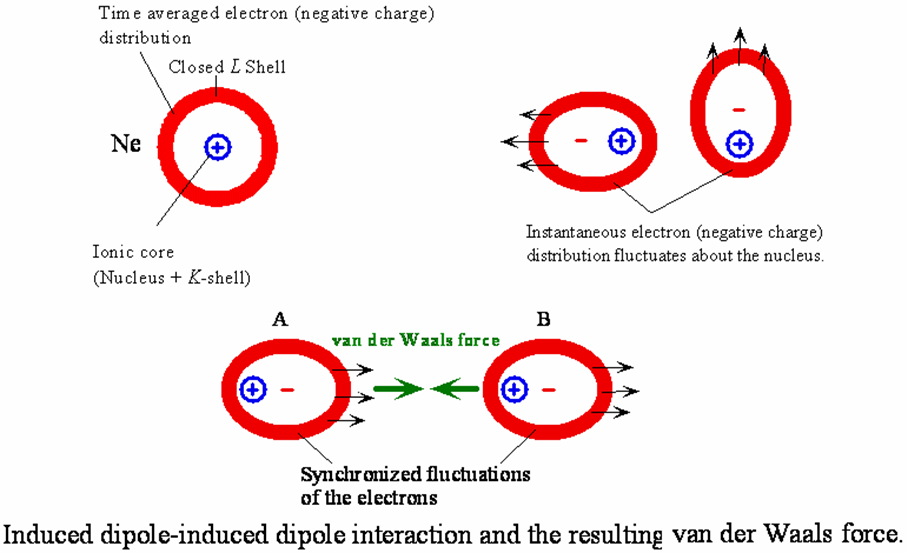
이온 결합, 공유 결합, 그리고 금속 결합은 강한 결합입니다. 이와 함께 약한 결합이 있죠. 말 그대로 결합 에너지가 약해 결합이 쉽게 끊어지는 결합입니다. 약한 결합에서 대표적인 원인으로 반 데르 발스 힘(van der Waals force)이 있습니다. 반 데르 발스 힘은 분자간, 혹은 분자 내에서 영역들간의 인력이나 척력을 말합니다. 일례로 이온이 아닌 중성의 분자에서 전자의 불균형 등으로 순간적인 쌍극자가 생성되면 이로 인하여 이웃하는 분자도 일시적으로 분극이 일어나서 유발 쌍극자(induced dipole)가 되며, 따라서 두 쌍극자 간에는 인력이나 척력이 발생합니다.

이는 네덜란드의 과학자, 요하너스 디데릭 반 데르 발스(Johannes Diderik van der Waals)로부터 명명되었죠. 반 데르 발스 힘에 의한 결합은 일반적인 화학 결합에 비해서는 상대적으로 약하지만 분자들간의 상호작용에 관여하므로 분자 화학, 응집 물리학 등 다양한 분야에서 사용이 되고 있습니다. 하지만 일부에서는 반 데르 발스 인력을 결합이 아니라 힘으로 보기 때문에 반드시 대응하는 비쌍극자가 있어야 한다고 보기도 합니다. 반 데르 발스 인력이 결합보다는 접착력에 가깝다는 말로, 일시적인 현상이란 뜻이죠. 통용되는 의미는 반 데르 발스 결합을 포함한 약한 결합은 주로 원자나 분자 내에서 양(+)의 영역과 음(-)의 영역이 순간적으로, 혹은 지속적으로 거리를 두고 존재하면서 형성되는 전기 쌍극자dipole)들이 서로 정전력으로 끌어당기면서 이루어지는 결합입니다.

반 데르 발스 결합은 2차 결합이라고도 하며, 결합 에너지는 보통 10 kJ/mol(0.1 eV/원자) 정도로 약합니다. 2차 결합은 실제로 모든 원자와 분자 사이에 존재하나, 이러한 결합의 효과는 전술한 세 종류의 강한(1차) 결합이 함께 존재할 때는 잘 드러나지 않죠. 2차 결합은 안정된 전자 배치를 가지는 비활성 기체나 공유 결합된 분자와 분자들 사이에서 볼 수 있습니다. 이러한 반 데르 발스 힘은 원자나 분자의 쌍극자에서 나오게 되죠. 반 데르 발스 힘을 중심으로 분자들간에 존재하는 힘을 분류해 보겠습니다.

분자 사이에 작용하는 힘의 종류는 다양하게 분류됩니다. 1) 쌍극자와 쌍극자 사이의 힘; 분자들의 운동이 활발할 수 없는 낮은 온도에서 분자들이 전하가 서로 다른 부분을 끌어당겨 결합하는 힘, 2) 쌍극자와 유도 쌍극자 사이의 힘; 쌍극자가 비쌍극자에 가까워져서 유도 쌍극자로 전환시켜 결합하는 힘, 3) 유도 쌍극자와 유도 쌍극자 사이의 힘; 비쌍극자들이 낮은 온도에서 순간적으로 분극이 일어나 유도 쌍극자들이 되어 결합하는 힘, 4) 수소 결합; 1) ~ 3)에서 특히 수소가 연관되는 힘과 결합, 5) 이온과 쌍극자 사이의 힘; 예를 들어 나트륨 양이온(+)과 물 사이의 힘, 또는 염소 음이온(-)과 물 사이의 힘. 용해 특히, 수화라고도 하죠. 이러한 힘은 분자 사이에 작용하는 힘, 혹은 반 데르 발스 힘에 해당하지는 않죠. 이상에서 반 데르 발스 힘은 좁은 의미에서는 2)와 3)이며, 넓은 의미에서는 1)과 4)까지 포함됩니다. 이온과 쌍극자간의 힘은 수소결합이 아니며, 이온이 포함되므로 반 데르 발스힘 역시 아닙니다. 반 데르 발스 힘에 의한 결합들 중에서 수소 결합이 가장 강하나, 전반적으로 원자들간의 강한 결합에 비해 매우 약합니다. 이상과 같은 분자 결합들에서 결합 에너지의 크기 순서는 '이온과 쌍극자 > 수소결합 > 쌍극자와 쌍극자 > 쌍극자와 유도 쌍극자 > 유도 쌍극자와 유도 쌍극자'의 순으로 정리됩니다.

예를 들어 고립된 원자 안에서 어느 순간에 전자들이 한쪽 방향으로 쏠리게 되면, 순간적인 쌍극자(temporary dipole)가 만들어지고 두 개의 이러한 쌍극자간에는 정전 인력에 의해 약한 결합이 일어나죠. 이러한 약한 결합은 특히 비활성 기체들이 낮은 온도에서 존재할 경우에 흥미롭습니다. 네온과 같은 비활성 기체도 핵과 전자간 위치의 불균형으로 반 데르 발스 결합이 일어나고는 합니다. 또한, 흑연(graphite)에서 3중 공유 결합에 해당하지 않는 전자가 상하부로 이동을 하여 전자가 머무는 층은 음(-), 없는 층은 양(+)의 전하를 띄게 되어 층간에 반 데르 발스 결합이 이루어지죠.

수소 결합은 수소(H)와 전기 음성도가 큰 원자(N, O, F) 사이의 분자 결합으로 다른 분자간 결합들에 비하여 상대적으로 강합니다. 즉, 분자 내 전자들의 치우침으로 인한 분자 결합이라는 점에서는 다른 분자간 결합들과 비슷하지만, 수소가 관여하고 또한 결합력이 유독 강하여서 '수소 결합'이라는 별도의 명칭으로 분류합니다. 수소 결합의 강력한 힘은 크게 두 가지의 이유를 들 수 있습니다. 먼저 전기 음성도의 큰 차이입니다. 즉, 분자간 결합은 기본적으로 전자의 치우침이 클수록 더 강력해집니다. 수소 결합은 비금속 중에서 전기 음성도가 가장 작은 수소와 전기음성도가 큰 원소들(N, O, F 등)사이의 결합으로 전자의 치우침 자체가 클 수밖에 없습니다. 다른 이유로 수소 원자의 독특한 특성때문입니다. 수소 원자는 전자가 딱 하나이며, 항시 쌍극성을 띌 수밖에 없는 원자 구조이죠. 이런 이유로 수소 원자는 다른 원자와 결합하여 안정된 화합물을 이루더라도 상시 쌍극성을 띄고 있는 영구 쌍극자(permanent dipole) 구조이며, 따라서 상시 양(+) 전하쪽에 해당하는 수소 측이 다른 분자의 음(-) 전하 영역과 결합을 이루고 있습니다.

수소 결합의 대표 선수는 물입니다. 물분자는 두개의 수소 원자가 하나의 산소 원자에 공유결합으로 연결된 상태이며, 산소의 전기 음성도가 상대적으로 커서 전자들은 많은 시간을 산소 쪽에서 보내게 됩니다. 즉, 물에서의 수소 결합은 전자를 끌어당기는 힘이 상대적으로 약한 수소 원자가 약한 양이온의 성질을 띠고, 전자를 끌어당기는 힘이 강한 산소 원자가 강한 음이온의 성질을 띰으로써 일어나게 됩니다. 따라서 물은 극성 공유 결합 물질이죠. 그리고 물 분자는 산소 쪽이 음(-), 수소 쪽이 양(+)으로 하전된 영구 쌍극자에 해당합니다.
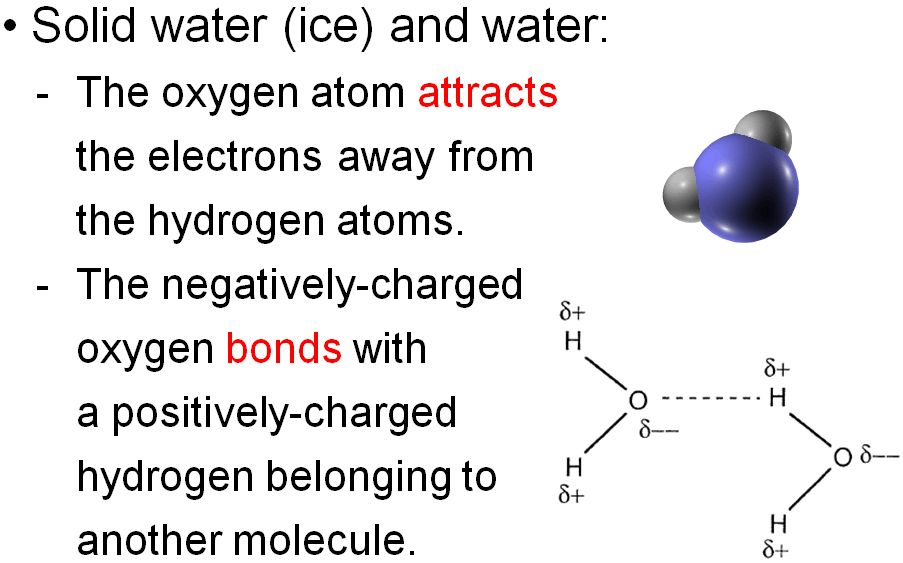

물 분자를 이루는 수소-산소-수소의 결합은 104.5°의 각도를 이루고 있으며 구부러진 모양으로 보입니다. 물 분자의 이러한 불균형 구조 때문에 산소는 음전하(-)를 갖게 되고, 수소 원자 쪽은 양전하(+)를 가져 쌍극자의 성질을 가지게 되는데 이것을 ‘극성’이라고 합니다. 물의 이런 극성 때문에 물 분자는 서로 결합해서 큰 덩어리를 만들 수 있습니다. 이때 사용되는 서로 다른 물 분자 사이의 산소-수소 간의 결합이 '수소 결합'이며, 우리가 물을 만지고 볼 수 있는 것은 수소 결합 덕분입니다. 물 분자는 공기보다 가벼워 서로 연결되어 있지 않으면 평상시 온도에서는 기체가 되어 모두 날아가 버리고 말죠. 만약 물 분자가 곧은 구조를 가지고 균형을 이루었다면, 물 분자의 극성은 사라지고 수소 결합도 불가능하게 됩니다. 그렇게 되면, 물은 -80 ℃에서 끓어 우리가 사는 세상에서는 기체가 되어 사라집니다. 강이나 바닷물은 물론이고, 생명체의 몸 안에 있는 물도 모두 기체가 되어 사라져 버릴 것입니다.


물과 얼음은 상태 변화가 일어나도 물질의 질량은 변하지 않지만 부피는 변합니다. 일반적으로 고체가 열을 받으면 부피와 길이가 늘어나는데 이것은 고체를 이루고 있는 작은 알갱이, 즉 원자나 분자들이 열을 받으면서 에너지를 얻어서 보다 활발하게 운동을 하면서 알갱이 사이의 간격이 넓어지기 때문이죠. 그래서 고체에서 액체로 상태가 변하면 부피가 증가하고, 반대로 액체에서 고체로 상태가 변하면 부피가 감소하는 것이 보통입니다. 예를 들어 초콜릿, 버터, 양초 등이 녹아 액체가 되면 부피가 증가하고, 다시 굳어 고체가 되면 부피는 감소하게 되죠.

그러나 물은 예외로 액체인 물이 고체인 얼음이 되면 부피가 증가하고, 얼음이 녹아 물이 되면 부피가 감소합니다. 그 이유는 물의 분자 구조에서 찾을 수 있죠. 물은 산소 원자 한 개에 수소 원자 두 개가 결합되어 있는 굽은 모양으로 그 꼭짓점에 산소 원자가 위치하고, 양 끝에 수소 원자 두 개가 위치한 모양을 하고 있습니다. 그런데 산소 원자가 수소 원자에 비해 공유 전자쌍을 끌어당기는 힘이 강해, 산소 원자는 부분적으로 음전하를 띠고 수소 원자는 부분적으로 양전하를 띠죠. 이로 인해 분자들 사이에 인력이 작용하게 되는데 , 이러한 분자 간의 결합을 수소 결합이라고 함은 앞서 설명한 바가 있습니다. 물이 얼면서 부피가 증가하는 것은 바로 이 수소 결합 때문이죠. 굽은 모양의 꼭짓점에 있는 산소 원자는 다른 물 분자의 수소 원자와 수소 결합을 이룰 수 있고, 또한 굽은 모양의 양 끝에 있는 2개의 수소 원자들도 각각 다른 물 분자의 산소 원자와 수소 결합을 이룰 수가 있죠. 그래서 한 개의 물 분자를 중심으로 4개의 물 분자가 정사면체 모양으로 배치하게 됩니다. 물이 냉각되면 물 분자들이 계속해서 3차원적 수소 결합을 형성하여 물 분자의 구조는 가운데가 비어있는 육각 모양을 가지게 되며, 이로 인하여 물이 액체로 있을 때보다 얼음으로 될 때 부피가 더 커지는 것입니다. 반대로 얼음에서 물이 될 경우,수소 결합이 깨지면서 자유로워진 물 분자들이 육각 구조의 빈 공간으로 들어가면서 고체인 얼음일 때보다 부피가 감소하게 됩니다.

물 분자에서 산소 원자쪽은 부분적인 음전하를 띠고, 수소 원자쪽은 부분적으로 양전하를 띠죠. 이렇게 분자 하나의 전하가 부분적으로 나뉘어 있는 것을 가리켜서 극성을 띤다고 하고, 이러한 성질을 띠는 분자를 극성 분자라고 합니다. 물분자의 구조가 굽은형인 이유는 전자쌍들의 반발 원리에 의한 것인데, 전자쌍들은 서로의 반발력이 최소가 되도록 멀리 떨어지려고 합니다. 그런데 공유되어 있는 전자쌍들의 반발력보다 공유되지 않은 전자쌍들의 반발력, 즉 밀어내는 힘이 더 크기 때문에 공유하고 있는 전자쌍이 한쪽으로 밀리게 되고, 자연히 굽은 모양이 되는 것이죠. 원래는 109.5도여야 하는데 104.5도 정도로 각이 작아졌습니다.

그런데, 물분자가 만약 일자형이라고 한다면, 힘의 평형을 이루듯이 전기적인 힘도 평형을 이루게 되죠. 그러면 전자의 쏠림 현상이 일어나지 않습니다. 그 예로, 이산화탄소의 경우, 가운데에 탄소가 위치 한 채로 180도 일자형의 모양입니다. 산소가 탄소보다 전기음성도가 크지만, 양쪽의 산소에서 똑같은 힘으로 전자를 끌어당기기 때문에 전자쌍의 쏠림 현상이 일어나지 않게 되고, 따라서 이산화탄소는 무극성이에요. 하지만 물 분자가 굽은형이기 때문에 한쪽에는 산소, 다른 한쪽에는 수소 원자 두 개가 위치하게 되고, 산소가 있는 쪽으로 전자가 끌어당겨지기 때문에 산소가 있는 방향은 약한 음전하를, 수소가 있는 방향은 약한 양전하를 띠게 되는 것입니다.

# 참고로 하고 있는 여러 자료의 도움에 감사를 표하며, 계속 업그레이드 됩니다.
# 의견과 조언, 수정과 요청은 늘 환영합니다. 댓글이나 전자메일로~ bkju@korea.ac.kr
# 저작자, 본 사이트를 반드시 표시, 비영리적으로만 사용할 수 있고, 내용 변경은 금지합니다.
풀어보기

더! 공부하기
'공부와 생각들 > 전자재료 소자' 카테고리의 다른 글
| 1-11. 금속 결정의 원자 배열 (0) | 2020.01.07 |
|---|---|
| 1-10. 에너지 밴드, 고체 (2) | 2020.01.07 |
| 1-8. 금속 결합, 고체 (0) | 2020.01.07 |
| 1-7. 공유 결합, 고체 (1) | 2020.01.07 |
| 1-6. 이온 결합, 고체 (0) | 2020.01.07 |