


원자는 어떻게 생겼을까요? 시작은 영국의 물리학자, 존 돌턴(John Dalton, 1766년~1844년, 영국)부터입니다. 그는 모든 물질들은 원자로 구성 되어있다는~ 원자설의 첫 제창자이죠. 원자설에서 그는 몇 가지를 주장하였습니다. 먼저, 같은 원소의 원자는 같은 크기와 질량, 성질을 가지고, 원자는 더 이상 쪼개질 수 없고, 원자는 다른 원자로 바뀔 수 없으며 없어지거나 생겨날 수 없고, 그리고 화학 반응은 원자와 원자의 결합 방법만 바뀌는 것으로, 원자가 다른 원자로 바뀌지는 않으며, 따라서 질량이 보존된다고. 그러나 동위 원소의 경우, 성질은 같으나 질량은 다르죠. 원자는 양성자, 중성자 등과 같은 더 작은 입자들로. 쪼개질 수 있고, 또한 원자는 핵분열이나 핵융합을 통하여 다른 원자로 바뀔 수도 있습니다. 돌턴의 원자설은 적지 않은 부분이 수정되어야 하지만, 현대 원자론의 근간을 이루는 내용임에는 틀림이 없습니다.

돌턴 다음으로는 톰슨 모형을 들 수 있습니다. 조지프 존 톰슨(Sir Joseph John Thomson, 1856년~1940년, 영국)은 음극선 연구 과정에서 광선이 휘어지는 것을 발견하고, 이를 통하여 음전하를 띈 미립자(나중에는 '전자'로 명명됨)들이 전극의 원자 내에 있다고 가정하였죠. 따라서 원자는 쪼갤 수 있고, 원자를 구성하는 요소는 전자들이라고 생각하였으며, 원자의 전기적인 중성을 고려할 때 양전하의 바다(혹은 구름)를 전자들이 떠다닌다고 가정, 건포도 푸딩 모델을 제안하게 되었습니다.

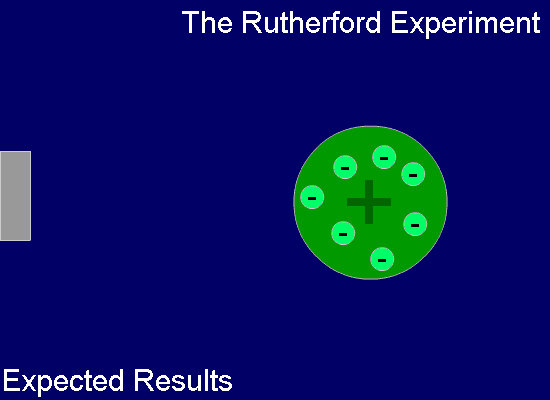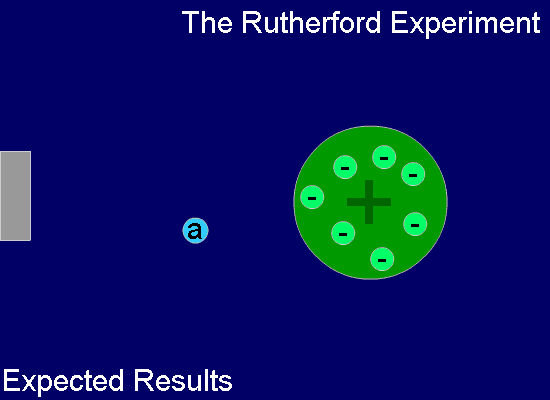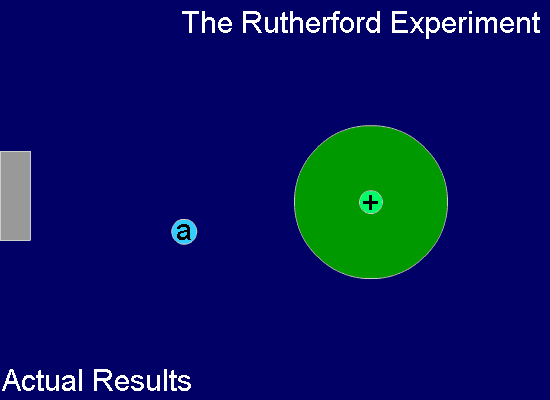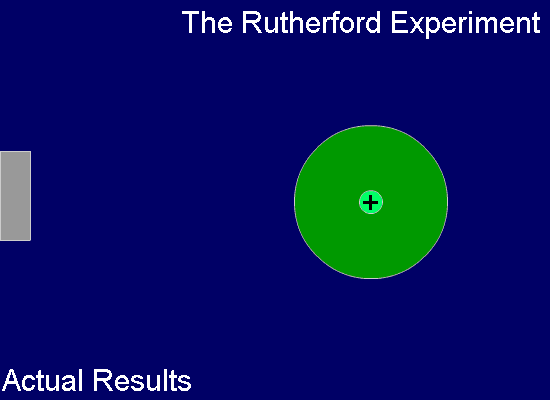
톰슨의 이러한 '건포도 푸딩 모델'은 그의 제자인 어니스트 러더포드(Ernest Rutherford, 1871년~1937년, 영국)에 의하여 부정되었죠. 즉, 러더포드는 얇은 금박을 중심에 두고 주위를 형광체를 칠한 판으로 둘러싼 상태에서 운동량이 큰 알파 입자(He2+ 입자)를 얇은 금박에 쏘는 실험을 합니다. 금박과 충돌한 알파 입자들은 대부분 그냥 통과하지만 극히 일부가 크게 휘어지거나 튕겨져 나오는 현상으로부터 원자의 중심 부분, 아주 작은 공간 안에 대부분의 질량을 가진 양전하가 모여있음을 확인하였고, 이로써 원자의 태양계 모델을 상상하였습니다.

이는 뒤를 이어 닐스 보어(Niels Bohr, 1885년~1962년, 덴마크)로 이어졌는데, 보어 모델은 여기에 수소의 불연속 스펙트럼을 토대로 하여 전자의 불연속적인 궤도와 함께 궤도 변경 시 에너지의 흡수와 방출이 일어남을 제안하고 있습니다. 즉, 방전관에서 수소 기체가 방전할 때 나오는 빛을 프리즘으로 분산시키면 가시광선 영역에서 불연속적인 선 스펙트럼이 나타나며, 이는 러더포드 모형에서는 설명할 수 없는 현상입니다. 따라서 보어는 불연속적인 선 스펙트럼을 설명할 수 있는 원자의 전자 궤도 모형을 제안하게 되죠. 즉, 원자핵 주위의 일정한 에너지 준위에만 전자들은 존재하게 되며, 전자들이 에너지 준위를 이동(전이)할 때, 그 차이만큼의 에너지가 흡수 혹은 방출됩니다. 핵에 가까운 쪽에 위치한 전자(바닥 상태)가 먼 쪽으로 이동하게 되면(들뜬 상태) 에너지를 흡수하고 반대로 바닥 상태로 이동하면 에너지를 방출하게 되죠. 수소 원자의 선 스팩트럼은 방전 전압에 의해 들뜬 상태로 올라간 전자가 바닥 상태로 내려오면서 방출하는 에너지의 형태로 설명이 됩니다.

그리고 마침내 현대의 원자 모델이 드러나게 되죠. 이는 양자역학의 등장으로 성립되었으며, 입자보다는 파동 함수로 스펙트럼 현상을 설명하는 것으로부터 시작됩니다. 즉, 전자들의 궤도는 존재하지 않고 전자를 발견할 확률만을 우리는 알 수 있다는 점, 이를 좀 더 들어가 보죠.
원자의 태양계 모형인 '러더퍼드-보어 모형'은 원자의 구조를 온전히 설명하기에는 일부 한계가 있었습니다. 먼저, 고전 전자기학의 라모 공식(Larmor formula)에 의하면 가속하는 전자는 전자기파를 방출, 점점 에너지를 잃게 되며, 결과적으로 핵을 향하여 나선 궤도로 신속히 추락하게 되는데, 이런 일이 실제로는 일어나지 않고 있었죠. 그리고, 전자가 궤도를 옮길 때에만 에너지의 출입이 일어난다는 점은 한 개의 전자로 이루어진 수소 이외의 다전자 원자들을 충분히 설명하기에는 부족하였습니다. 이러한 상황에서 1923년 루이 드브로이(Louis de Broglie, 1892년~1987년, 프랑스)는 움직이는 모든 입자들은 파동 특성도 지니고 있음을 제안하였고, 뒤를 이어 에르빈 슈뢰딩거(Erwin Schrodinger, 1987년~1961년, 오스트리아)는 전자를 점 입자가 아닌 파동함수로 기술하게 되며, 이를 통하여 보어 모형의 일부 한계를 설명하였습니다.

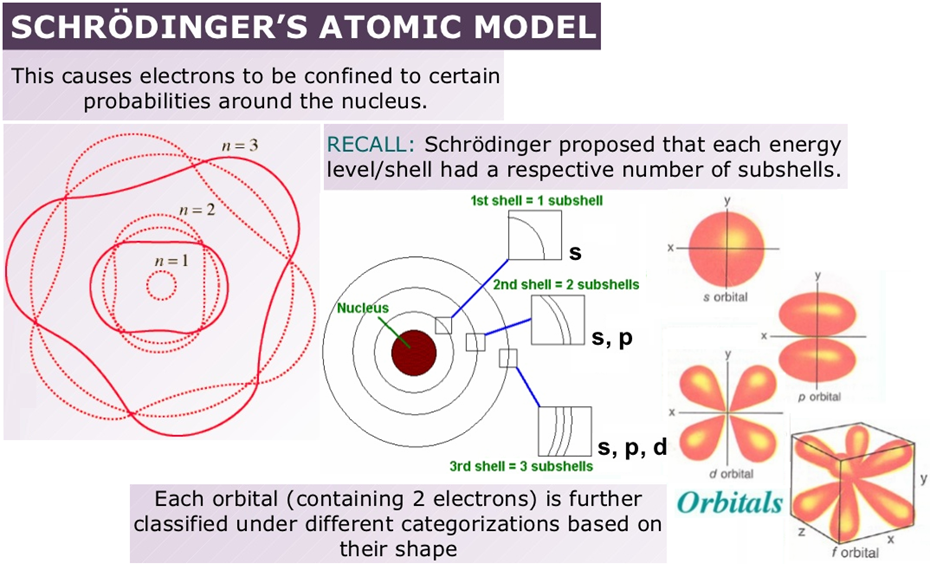
오비트(orbit)와 오비탈(orbital)의 이야기로 풀어가 봅니다. 오비트는 원자 궤도로 마치 태양 주위를 공전하는 행성으로 전자를 생각한 개념이며, 오비탈은 궤도 함수로 전자가 존재할 가능성이 있는 핵 주위의 공간이나 영역을 의미합니다. 즉, 오비트는 핵 주위를 회전하는 전자의 경로로 2차원 운동을 나타내며, 전자의 명확한 이동 경로를 나타내므로 불확정성 원리를 따르지 않죠. 원형으로 방향성이 없고, 원자 궤도는 뉴턴의 운동 법칙에 따라 동일한 각속도를 가지면서 음으로 하전된 전자를 양으로 하전된 핵이 끌어당기므로 원형의 원자 궤도가 만들어집니다. 원자 궤도에는 각각 2n^2의 전자들을 수용할 수가 있습니다. 오비탈은 전자가 존재할 확률이 있는 핵 공간 주위의 영역을 의미합니다. 그리고 핵 주위에서 전자의 3차원 운동을 나타내죠. 오비탈은 불확정성 원리를 따르므로 전자의 이동 경로를 명확히 지정하지는 않고, 전자는 오비탈 영역 내의 어디에서나 있을 수 있죠. 오비탈은 다양한 모양들로 존재합니다. 예를 들어, s 오비탈은 구형, p 오비탈은 아령 모양입니다. s 오비탈을 제외한 다른 오비탈들에는 방향성이 있죠. 오비탈들은 s, p, d, f로 구분이 되며 각각의 오비탈이 수용 가능한 전자들의 수는 2개, 6개, 10개, 16개입니다.

이를 시작으로 정립되고 있는 현대의 원자 모형은 한 사람의 노력이 아닌, 양자역학과 관련한 여러 과학자들의 노력에 의해 진행이 되어오고 있죠. 즉, 전자와 원자를 비롯한 여러 작은 입자들의 미시 세계를 다루는 학문인 양자역학은 20세기 초부터 보어를 비롯하여 막스 플랑크와 아인슈타인, 드 브로이, 슈뢰딩거, 하이젠베르크 등의 학자들의 기여와 함께 활발하게 연구되었고, 이를 통하여 원자의 구조, 원자 내에서의 전자들의 거동에 대한 해석도 정리되어 갑니다. 현대의 원자 모형에서는 원자에서 전자의 위치를 정확히 알 수는 없으며, 알 수 있는 것은 위치에 따른 전자의 존재 확률로, 앞서 말하였듯이 이를 원자의 오비탈(orbital)이라 합니다. 오비탈은 해당 원자에 대한 슈뢰딩거의 방정식을 풀어 얻을 수 있는데, 오비탈은 세 가지 양자수인 주양자수(principal quantum number), 각운동량 혹은 방위 양자수(angular-momentum quantum number), 그리고 자기 양자수(spin quantum number)로 결정됩니다. 겨우 세 가지 수의 조합을 이용해 원자의 모양을 예측하고 나타낼 수 있다는 것은 굉장히 흥미로운 사실이며, 이러한 결과가 인위적인 조작이 아니라, 원자와 미시 세계 그 자체의 특성이며, 수학적 계산을 통해 자연스럽게 유도되는 결과라는 사실에서 다시 한번 놀라지 않을 수가 없죠.
흔히들 양자역학에서 그 이론적 근거가 부족하다 하여 믿지 않거나 잘못된 학문으로 치부하는 경우가 있으며, 양자역학이 태동하던 20세기 초중반에는 당대의 저명한 학자들조차도 양자역학이 옳은 것인지에 대해 치열한 논쟁을 펼쳐왔습니다. 아인슈타인은 ‘신은 주사위를 굴리지 않는다’며 전자의 존재를 확률로밖에 알 수 없다는 등의 양자역학에서의 확률론적 해석을 강하게 부정해 왔고, 슈뢰딩거 방정식을 만들어 낸 슈뢰딩거조차 ‘슈뢰딩거의 고양이 역설’을 통해 양자역학을 강하게 부정하였죠. 그러나 현재까지도 양자역학은 많고 다양한 실험 결과들을 완전에 가깝게 설명해내고 있으며, 이제는 상대성이론과 함께 현대물리학의 양대 산맥으로 자리 잡았습니다. 또한 다른 학문과 융합해 양자화학, 양자생물학 등의 학문을 만들어내며 이전까지 밝혀내지 못했던 더 많은 세상의 비밀들을 밝히는 데에 큰 역할을 하고 있습니다. (이상, KOSMOS 일부 참조)
# 참고로 하고 있는 여러 자료의 도움에 감사를 표하며, 계속 업그레이드 됩니다.
# 의견과 조언, 수정과 요청은 늘 환영합니다. 댓글이나 전자메일로~ bkju@korea.ac.kr
# 저작자, 본 사이트를 반드시 표시, 비영리적으로만 사용할 수 있고, 내용 변경은 금지합니다.
풀어보기

더! 공부하기
blog.daum.net/jbkist/5038?category=855181
원자, 원자들
19세기는 과학의 역사에서 풍요와 완성의 시대였다. 아마 서구 열강에게는 모든 면에서 그랬을 듯싶다. 영국은 눈부신 빅토리아 시대를 맞아 해가 지지 않는 제국을 만들었고 대륙의 프랑스는
blog.daum.net
blog.daum.net/jbkist/5342?category=855181
양자역학, 어렵지만... 그래도~
양자도약을 예측하다! - 양자역학의 입문과 현재까지 양자역학... 과연 무엇이라고 할 수 있을까. 양자역학의 대가이자 QED 이론을 설립한 리처드 파인만(Richard Feynman)은 다음과 같이 말했다. “양
blog.daum.net
blog.daum.net/jbkist/5382?category=855181
보어와 아인슈타인
20세기 들어 인류 역사상 세상을 놀라게 한 ‘천재들’은 많다. 그중에서도 상대성 이론을 밝히고 양자역학에 기여했다면 그는 어떤 범주에 드는 천재일까. 독일의 물리학자 알베르트 아인슈타
blog.daum.net
blog.daum.net/jbkist/5413?category=855181
상대성 이론과 양자 역학의 연결
세계는 넓고 천재는 많다. 천재들은 빛을 쫓는다. 갈릴레이는 빛의 속도를 측정하려 했고 뉴턴은 빛의 성질을 밝히려 했다. 아인슈타인은 빛을 통해 양자역학의 기초를 만들었다. 위대한 과학자
blog.daum.net
'공부와 생각들 > 전자재료 소자' 카테고리의 다른 글
| 1-5. 화학적 결합, 고체 만들기 (0) | 2020.01.07 |
|---|---|
| 1-4. 주기율표 (0) | 2020.01.07 |
| 1-3. 전자의 배열 (2) | 2020.01.07 |
| 1-2. 원자의 구조 (0) | 2020.01.07 |
| 0. 시작하며 (0) | 2020.01.03 |