

자연과 우주의 모든 것들은 어떻게 만들어졌을까? 신화나 전설, 종교, 그리고 신의 능력일까? 과학의 영역에서는 시간과 공간, 그리고 공간 내의 모든 물질들은 우주의 탄생과 함께 시작된 것으로 보고 있습니다. 즉, 초고밀도, 초고온 상태의 어느 시점에서 팽창이 일어나 우주가 탄생하고, 이로부터 우주를 구성하는 물질이 만들어졌다는 '빅뱅(대폭발) 우주론'에 무게를 두고 있죠. 즉, 초기의 우주는 밀도와 온도가 매우 높아서 여러 힘과 빛 마저도 모두 뭉친 상태로 존재하였고, 이후 찰나의 급격한 팽창이 일어나고, 이 과정에서 우주가 냉각되면서 물질의 이루는 기본 입자들, 쿼크, 양성자, 중성자, 그리고 전자들이 만들어지죠. 이후 온도가 내려가는 과정을 통하여, 수소, 헬륨 원소들이 먼저 만들어집니다. 우주에는 밀도와 온도가 높고 낮은 부분들이 불균일하게 존재하게 되며, 밀도가 높은 곳에서는 중력에 의해 물질이 더 뭉쳐지고 별이 만들어지죠. 별의 생성과 소멸, 온도와 밀도의 상승 등을 통하여, 핵융합이 일어나고 이로부터 또 다른 물질들이 만들어지고... 별의 내부에서의 핵융합 과정으로 철(Fe)까지의 원소들이 생겨납니다. 그리고 별은 중력으로 인한 계속되는 수축 과정 후에 또 폭발이 일어나고, 이 순간의 막대한 에너지는 또 다른 핵융합 과정을 일으키고 더 많은 원소들이 만들어져서 우주 공간으로 흩어집니다. 이런 과정을 통하여 우주, 지구, 그리고 우리 주변에는 100여개가 넘는 원소들이 존재하고 있죠.

이와 같이 대부분의 원소들은 우주 생성 초기의 핵합성, 별 내부에서의 핵융합, 그리고 초신성 폭발 등의 과정으로 태어났습니다. 원소들은 1860년대에는 60여 종 정도가 알려졌으며, 과학자들은 성질이 비슷한 원소들을 묶거나, 특정 기준에 따라 배열하여 원소들의 세계에서 규칙성을 찾으려 노력하였죠. 주기율표(periodic table)는 이러한 원소들을 고유의 성질에 맞도록 배열한 표이며, 다양한 시도를 거쳐 1869년, 러시아의 멘델레예프(D. Mendeleev)가 원소들을 원자량 순서로 나열하면서 기초를 마련하였습니다. 그는 당시 알려진 약 60여 개의 원소를 주기성 및 화학적 성질에 따라 체계화하였죠. 그로부터 무려 150여 년이라는 시간이 흘렀습니다. 멘델레예프의 원소 주기율표에는 후대 과학자들이 새롭게 발견한 원소로 가득합니다. 자연적으로 존재하는 원소 92개, 이에 인공적으로 만들어진 원소들을 더한 총 118개 원소로 채워져 있으며, 계속하여 추가, 수정, 보완이 되고 있습니다. 물론, 멘델레예프가 원소 주기율표를 최초로 작성한 것은 아니죠. 독일의 되베라이너가 가장 먼저 원소의 성질과 원자량 사이의 연관성을 찾으려 했고, 역시 독일의 마이어는 1864년에 49개 원소로 배열표를 만들기도 하였습니다. 다만, 멘델레예프의 원소 주기율표의 의미는 발견되지 않은 원소에 대한 존재와 성질을 예측한 것에 있습니다. 즉, 멘델레예프의 주기율표에는 빈자리들이 있었으며, 언젠가는 채워질 것으로 예상하였죠. 그리고 후일, Sc, Ga, Tc, Ge 등이 발견됩니다. 그리고, 멘델레예프의 주기율표 이후, 발견된 원소들의 수가 증가하면서 더 많아짐에 따라 원소들을 원자량 순서대로 배열할 경우 성질이 주기율과 맞지 않는 부분이 나타나게 되었으며, 이후 원자를 구성하는 입자들이 밝혀지면서 원소의 주기적인 성질이 원자량보다는 양성자의 수, 즉 원자 번호와 관계가 있음이 명확해졌습니다. 즉, 영국의 헨리 모즐리는 음극선관을 이용, X 선의 파장을 연구하여 양성자 수에 따라 화학적 성질이 달라진다는 것을 밝혀내고, 이를 토대로 1913년에 멘델레예프의 주기율표를 개량, 원자번호의 순서에 따라 배열하였으며, 현대 사용하는 주기율표를 탄생시켰습니다.

원소들을 원자 번호에 따라 배열할 경우, 원자의 성질에서 반복적으로 성질이 비슷해지는 주기성이 나타나죠. 즉, 성질이 비슷한 원소들을 세로로 묶을 수 있으며, 이를 '족(group)'으로 표현합니다. '족'은 IA부터 IIA, IIIA, IVA, VA, VIA, VIIA, 그리고 VIIIA까지 여덟 개가 있으며, IIA와 IIIA 사이에 IIIB 등으로 나타낸 전이 원소(transition element)들이 표시됩니다. 설명을 이어가 보죠. IA(1족)에 속하는 원소들, H, Li, Na, K 등은 보통 수소를 제외하고는 녹는점이 낮으며, 화학적으로 반응성(활성)이 매우 큰 금속으로 알칼리 족으로 불립니다. 반면에 VIIIA(8족)에 해당하는 He, Ne, Ar 등은 매우 안정하여 화학적 반응성이 매우 낮아 불활성 기체(inert gas)라 하죠. VIIA(7족)에 속하는 원소들은 역시 반응성이 높아 할로겐 족이라고 합니다. 이와 함께 B로 표시되는 여러 '족'의 원소들은 대부분 녹는점이 높고, 전체적으로 화학적 특징이 비슷하여 전이 원소라 부릅니다.


반면에 가로 라인에 해당하는 원소들은 '주기(period)'로 분류되는데, 1부터 7 정도까지 표시가 되어 있죠. 같은 주기에 속하는 원소들은 최외각 껍질이 같다는 공통점은 있지만, 화학적 유사성이 거의 없습니다. 이러한 '주기'의 수는 원자 내 전자 껍질의 수를 나타내며, 주기가 커질수록, 즉 전자 껍질의 수가 증가할수록 원자의 크기도 증가합니다. 가장 바깥쪽 전자 껍질에서는 전자를 잃거나 얻으면서 화학 결합(반응)이 일어나게 되고, 따라서 여기에 있는 전자를 최외각 전자, 혹은 '원자가 전자'라고 하며, 이에 의해서 원자의 화학적 성질이 결정됩니다. 바깥쪽 전자 껍질이 꽉 찬 다음에 다음 주기로 넘어가게 되죠. 각 주기별로 2, 8, 8, 18, 18, 32, 32 개의 전자들이 포함되며, 이를 통하여 n이 1, 2, 3, 4 등일 때 각각 2개, 8개, 18개, 그리고 32개 등의 전자가 들어갈 수 있다는 규칙, 즉 원자의 양자화 규칙과 연관되어 있음을 알 수 있습니다.


'족(group)'에 관하여 조금 더 들어가 보죠. 같은 세로 라인에 위치하면 같은 '족'에 해당하며, 화학적 성질을 결정하는 원자가 전자의 수가 같으므로 당연히 화학적 성질이 비슷합니다. 예를 들어 3주기 1족 원소인 나트륨(Na)은 전자 껍질이 세 개이고 원자가 전자 수가 한 개이죠. 리튬(Li)의 경우, 2주기 1족 원소로, 전자 껍질은 두 개, 원자가 전자 한 개를 가지고 있어서 리튬(Li)과 나트륨(Na)은 같은 족으로 이들의 화학적 성질은 비슷합니다. 그리고, 전자를 잃고자 하는 성질이 강할 때 이를 금속성이라 하며, 금속성 원소들은 주기율표의 왼쪽(1~13족) 영역에 위치하죠. 반면에 비금속성 원소는 전자를 받아들이고자 하는 성질인 전자 친화도가 큰 원소들입니다. 이러한 비금속성 원소들은 수소(H)를 제외하고는 비금속들은 주기율표의 오른쪽(14~18족)에 위치하게 됩니다. 즉, 금속 원소들은 주로 주기율표의 왼쪽과 가운데 부분, 비금속 원소는 주로 오른쪽에 위치하죠. 금속 원소와 비금속 원소의 경계에 있는 원소들은 두 가지 원소의 성질을 모두 가지고 있으며, 규소(Si), 저마늄(Ge) 등이 이에 해당됩니다.



다음으로 전이 금속(transition metal), 혹은 전이 원소(transition element)에 관하여 설명을 해 보겠습니다. 이는 주기율표의 d와 f 구역의 원소들로, 4에서 7주기, 3족에서 12족까지의 원소들이 포합됩니다. 전이 원소라는 이름은 원소들을 분류하던 초기에 일반적인 원소들이 연결되는 과정에 있는 원소라는 뜻으로 생겼지만, 지금은 크게 의미가 없으며 또한 전이 원소들이 모두 금속이라 전이 금속이라고 부릅니다. 일반적인 전형 원소들의 경우, 같은 '주기'라도 '족'이 달라지면 화학적 성질이 크게 변화하지만 전이 금속들은 같은 주기에서도 유사한 특징을 갖는 경우가 많습니다. 특히, 첫 주기 전이 금속인 스칸디움(Sc)에서 아연(Zn)까지는 전이 금속들을 대표하는 원소들이죠. 또한, 전이 금속은 특이하게도 이온화되는 과정에서 4s 오비탈의 에너지가 3d 오비탈의 에너지보다 상당히 높아지며, 이로 인하여 중성 원자 상태에서 에너지 준위가 3d 보다 낮았던 4s 오비탈에서 전자가 먼저 나가게 됩니다. 즉, 전이 원소들은 d, f 준위들을 함께 가지고 있는데, 원자 번호가 20 이상이 되면 s와 d 준위 등의 차이가 매우 작아서 전자들이 쉽게 옮겨 다니며 주기율표의 규칙이 종종 위반됩니다. 그로 인해 쉽게 전자를 받거나 잃어버려 결합 반응도 분리 반응도 잘 일어나죠. 즉, 촉매로 쓰여 반응을 유발하고 자기는 떨어져 나오는 역할을 종종 합니다. 그리고, 전이 금속과 반응한 화합물인 착화합물의 경우, 전이 금속의 d 궤도 전자들의 에너지값에 의해 특정 파장의 빛을 흡수하여 색이 변화하고 다양한 색을 만들 수 있습니다. 다른 특징들을 들어보면, 단일 원소로는 모두 금속이며, 화합물을 이루는 경우 대부분 상자성(常磁性)을 띕니다. 요약컨데, 전형 원소들은 주로 최외각 궤도로 s, p를 가지며 전자 배열의 규칙을 잘 따르는 모범 원소들, 전이 원소들은 d, f의 최외각 궤도를 가지고 규칙을 지키기보다는 수시로 변화를 하는 매력적인 원소들로 생각됩니다.


알칼리 금속의 경우, 주기율표의 1족에서 수소를 제외한 나머지 원소들을 말하며, Li, Na, K, Rb, Cs, Fr 등이 해당됩니다. 즉 최외각 궤도에 한 개의 전자만을 가지고 있죠. 알칼리 금속은 물과 활발하게 반응하는 공통점이 있으며, 공기 중의 산소와도 반응할 만큼 반응성이 크기 때문에 자연계에서는 원소 상태가 아니라 이온이나 다른 원소와 결합한 상태로 존재합니다. 보존 시에는 빛이 들어오지 않은 서늘한 곳, 갈색병에 탄화수소 등을 채워 산소나 물 등과의 접촉을 차단하거나 석유나 파라핀 속에 넣어 보관하죠. 피부와의 반응 그리고 폭발을 주의하여야 합니다. 최외각 전자가 한 개라서 반응이 잘 일어나며, 특히 원자 크기가 큰, 따라서 핵의 구속력이 약한 알칼리 금속의 반응이 더 크게 일어납니다. 물에 녹으면 수산화(OH) 이온을 생성하므로 알칼리 금속이라 부르죠. 주변에서 흔히 볼 수 있는 소금에는 나트륨(Na) 이온이 들어 있으며, 칼륨(K) 이온은 나트륨 이온과 함께 세포 속에 존재하며, 신경 세포에서 자극이 전해지는 과정에서 중요한 역할을 합니다.

할로겐(halogen) 원소, 이는 주기율표의 17족에 해당합니다. 최외각 전자 껍질에 7개의 전자들이 있어 다른 원소들로부터 전자를 한 개만 받으면 쉽게 음이온이 되죠. 따라서 최외각 전자가 한 개인 수소나 알칼리 금속과 격렬하게 반응을 합니다. 핵의 영향력을 크게 받는 낮은 '주기'일수록 반응성이 크며, 비금속성으로 독성이 강하여 주의가 필요합니다. 소독제나 표백제 등에 많이 쓰이고 있죠. 금속과 반응하여 염(鹽)을 주로 만들므로 그리스어로 '소금'을 뜻하는 'hels'와 '만들다'라는 뜻의 'genn'에서 유래하여 halogen이라는 이름이 만들어졌죠. 조염(造鹽)원소라고도 합니다. 비금속 원소인 할로겐은 전기나 열을 잘 통하지 않고, 각각 특유의 색깔을 띠며, 화학 반응을 활발하게 하는데, 특히 비금속 원소 중 반응성이 크기 때문에 자연계에서는 순수한 원소 상태가 아닌 다른 원소와 결합한 상태로 존재합니다.

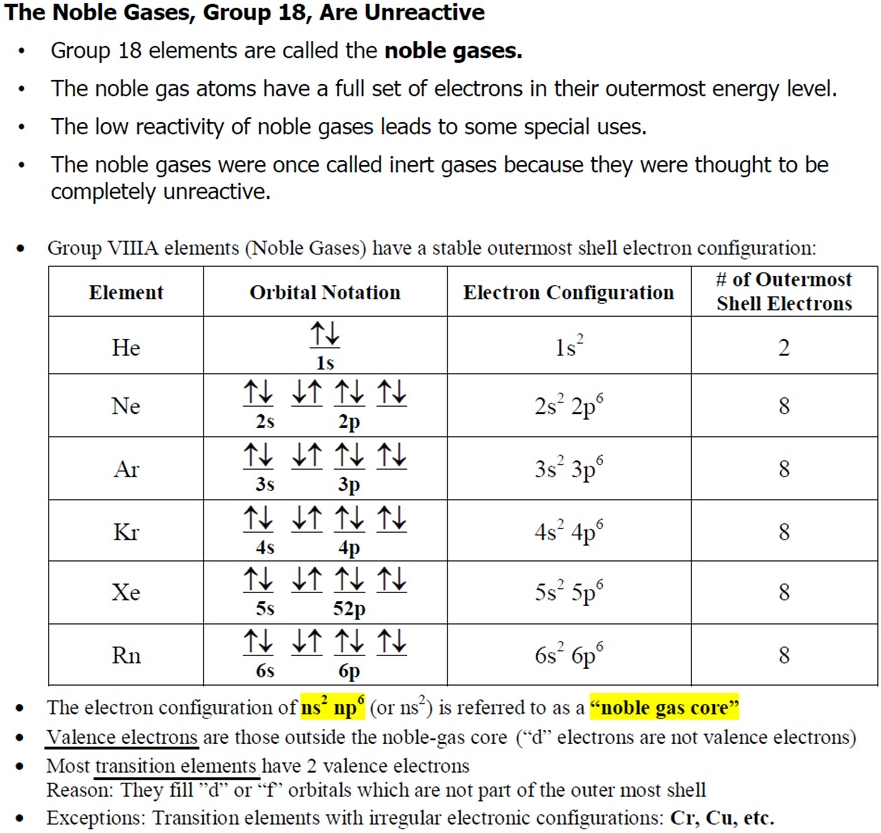
비활성 기체(inert gas), 혹은 귀족 기체(noble gas)는 주기율표의 18족 원소를 말합니다. 최외각 궤도가 전자들로 꽉 채워 있어서 전자를 주고받을 이유가 없어 화학 결합, 즉 반응을 하지 않죠. 예외로 Xe이 산소나 할로겐 원소와 반응을 하기도 합니다만. 헬륨(He), 네온(Ne), 아르곤(Ar), 크립톤(Kr), 제논(Xe)은 제외하고, 그리고 라돈(Rn)이 해당되며, 118번 원소인 오가네손(Og)는 비활성 기체가 아닐 가능성이 높으며, 현재 준금속으로 추정하고 있죠. 그리고 18족은 아니지만, 질소도 비활성 기체에 포함됩니다. 상온에서 기체 상태이며, 다른 원자들과 결합을 하지 않아 단원자 분자라고도 부릅니다. 반응성이 거의 없어 충진제로 사용되며, 특히 네온사인이나 형광등의 조명 충전제로도 유용하죠. 다만, 헬륨과 네온을 제외한 보다 무거운 기체들은 불소 등과 결합을 하는 것으로 나타나고 있고, 또 헬륨도 일부 결합이 확인된 바 있어 이제는 정의가 다소 변하고 있습니다.
# 참고로 하고 있는 여러 자료의 도움에 감사를 표하며, 계속 업그레이드 됩니다.
# 의견과 조언, 수정과 요청은 늘 환영합니다. 댓글이나 전자메일로~ bkju@korea.ac.kr
# 저작자, 본 사이트를 반드시 표시, 비영리적으로만 사용할 수 있고, 내용 변경은 금지합니다.
풀어보기


더! 공부하기
19세기의 화학, 그리고 주기율표
19세기의 시작과 함께 기억할만한 사건은 전지의 발명이다. 이탈리아 파비아대의 알렉산드로 볼타(1745~1827)는 전기를 연구하던 도중 전지를 발명했다. 전기, 특히 마찰전기의 존재와 성질은 오래
blog.daum.net
blog.daum.net/jbkist/5532?category=855181
주기율표는 진화한다?
주기율표란 원소를 배열한 표를 말한다. 원자핵 속에 들어있는 양성자수인 원자번호와, 전자 배열, 그리고 화학적 특성에 따라 원소를 배열하고 있다. 주기율표를 만드는 것을 처음 시도한 사람
blog.daum.net
'공부와 생각들 > 전자재료 소자' 카테고리의 다른 글
| 1-6. 이온 결합, 고체 (0) | 2020.01.07 |
|---|---|
| 1-5. 화학적 결합, 고체 만들기 (0) | 2020.01.07 |
| 1-3. 전자의 배열 (2) | 2020.01.07 |
| 1-2. 원자의 구조 (0) | 2020.01.07 |
| 1-1. 원자 모델 (3) | 2020.01.07 |