강철(鋼鐵, steel)은 철(iron, Fe)을 주성분으로 하는 금속 합금을 말하며,철이 가지는 성능(강도, 인성, 자성, 내구성, 내열성 등)을 인위적으로 더 개선한 물질입니다. 특히 건축물 등에 구조재로 많이 사용하죠. 순수한 철은 강도와 경도가 다소 약하므로, 탄소를 넣어 강화하지만 탄소의 양이 증가할수록 연성보다는 취성이 강해져서 특히 구조재로 사용할 경우 깨어지는 문제가 발생할 수도 있죠. 따라서 용도에 맞춰 탄소의 함량을 조절하며, 내부식성이나 내열성 등을 높이기 위해 다른 원소들을 더 첨가하기도 합니다. 대부분 탄소의 함유량은 0.2~2wt% 정도의 범위이며, 탄소 함유량이 0.035 ~ 1.7wt%일 경우 강철, 0.035wt% 이하는 연철, 1.7wt% 이상은 주철(무쇠)로 구분하며, 총칭하여서 철강이라고 하죠. 구조재로서 강절이 가진 장점들은 가격, 가공성, 즉 다양한 용도에 폭 넓게 적용될 수 있는 강도와 연성 등에 있습니다.


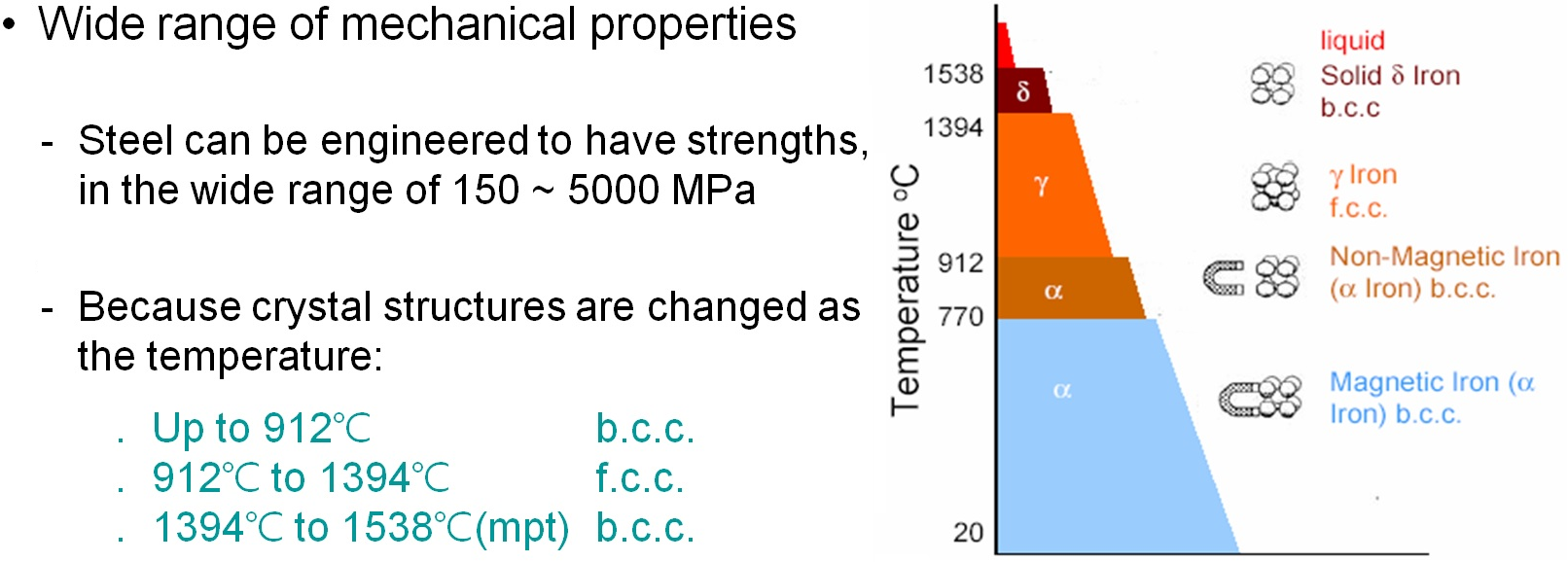
먼저 철(鐵, iron)에 관하여 알아보겠습니다. 이는 쇠로도 불리우며, 원소 기호는 라틴어 Ferrum으로부터 Fe, 원자번호는 26입니다. 철의 상태는 온도가 증가할수록 고체(알파철, 감마철, 델타철), 액체, 그리고 기체로 구분하며, 온도의 변화에 따라 결정(분자)의 결합 구조가 바뀌어서 성질(자성, 내식성, 취성 및 경도, 인성과 연성, 부피 등)에서도 차이가 생기기 때문이죠. 즉, 섭씨 770도까지는 체심 입방(bcc) 구조를 갖는 알파철이며 자성을 유지하고 있고, 섭씨 770~912도의 범위에서는 알파철이지만 자성을 잃게 됩니다. 그리고 섭씨 912~1,394도에서는 면심 입방(fcc) 구조의 감마철, 섭씨 1,394도부터는 다시 체심 입방 구조를 갖는 델타철로 구분됩니다. 녹는점은 섭씨 1,538도이죠. 알파철을 기본으로한 고용체들은 라틴어 Ferrum으로부터 페라이트(ferrite)라 명명하였고, 합금원소가 녹아 들어가서 감마철과 같은 면심입방정을 이루는 철강 및 합금강을 오스테나이트(austenite)라 부르죠. 이는 영국의 금속공학자의 이름에서 따왔습니다. 이외에도 철 원자 세개에 탄소 원자 하나가 반응하여 만들어지는 화합물인 시멘타이트, 시멘타이트와 페라이트의 층상 구조인 펄라이트 등, 다양한 종류와 다양한 명칭들이 있습니다.

구조용 금속은 기본적으로 연성과 인성이 있는 매트릭스 물질에 강도와 취성을 보완하기 위한 입자 물질을 더해서 만들어지죠. 즉, 매트릭스 물질은 연성과 함께 균열 등에 대해 저항력을 제공하고, 강화용 입자 물질은 강도를 보완합니다. 강철도 마찬가지입니다. 페라이트를 매트릭스로, 시멘타이트를 강화용 입자로 사용하죠. 기본적으로 철을 매트릭스로 하여 탄소의 함량으로 특성을 조절하는데, 탄소 함량이 0.15wt% 이하인 경우, 저탄소강(low carbon steel)으로 연성이 좋습니다. 대략 항복 응력은 150MPa, 인장 강도는 300MPa, 그리고 연성은 35% 정도이죠. 탄소의 함량을 늘려 0.15 ~ 0.4wt%에 이르게 되면, 보다 강해져서 항복 응력은 400MPa, 인장 강도는 550MPa, 그리고 연성은 20% 정도입니다. 연강(mild steel)은 이 범위에 속하는데, 약 0.25wt%의 탄소 함량을 가지며, 가장 사용량이 많고 대중화되어 있습니다. 탄소 함량이 0.4wt%가 넘게 되면, 매우 큰 강도를 가지게 되어 연마나 가공용 도구 등에 사용이 되죠.

철과 탄소에 관한 상태도를 살펴봅니다. 고체의 순수한 철은 알파상과 감마상, 그리고 델타상으로 존재하죠. 먼저, 공융점은 탄소 함유량 4.3wt%, 온도 섭씨 1,148도에서 나타납니다. 이 온도에서부터 액체 상태의 철이 감마철과 시멘타이트로 이루어진 고체로 바로 응고됩니다. 다음으로 공석 반응점(eutectoid reaction point)입니다. 탄소 함유량 0.76wt%, 섭씨 727도의 온도에 해당하죠. 공석 반응은 고용체가 냉각하면서 2개 이상의 상으로 동시에 변화하는 반응으로 반응 온도는 각각의 용융 온도보다 낮으며, 두 개 이상의 고체상으로 이루어진 조직을 갖습니다. 철과 탄소의 합금에서는 0.022wt% 탄소를 함유한 알파상과 6.7wt% 탄소의 시멘타이트상이 층상 구조로 존재하게 되죠.

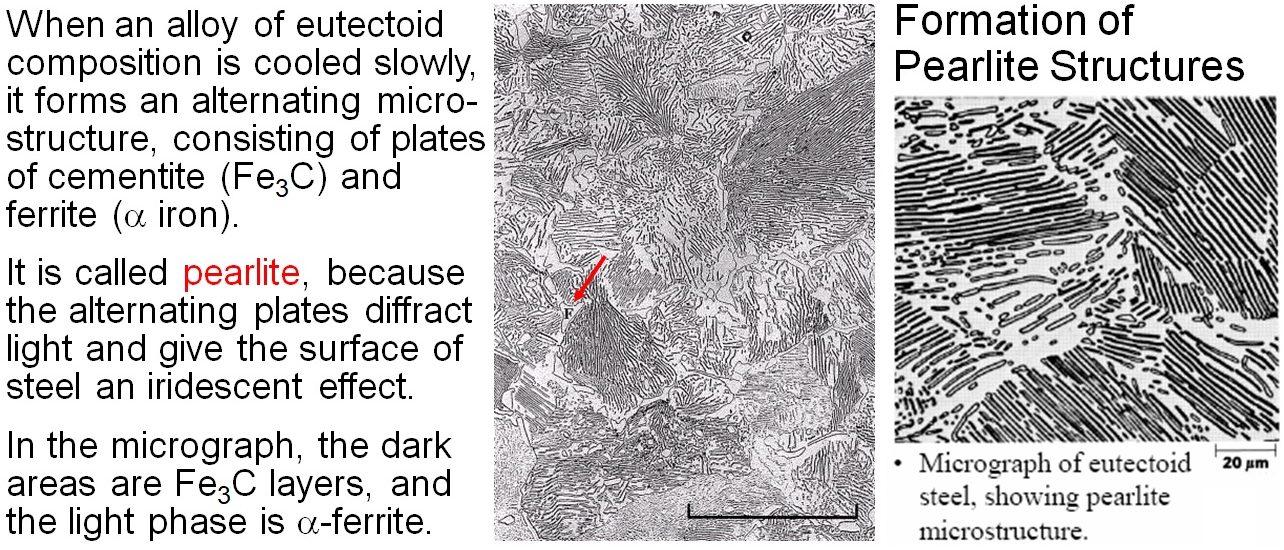
공석 반응에서는 높은 온도의 상도 고체입니다. 감마상 오스테나이트가 공석 반응 온도인 섭씨 727도 이하로 내려가면 알파상 페라이트와 시멘타이트 판상 구조들이 차곡차곡 쌓인 층상 구조를 형성하게 되죠. 이러한 구조는 빛의 굴절과 반사를 통해 표면을 진주처럼 반짝이며 빛나게 하여 펄라이트라 부릅니다. 펄라이트 구조는 대부분의 조성에서도 존재하지만, 공석 반응을 통하면 펄라이트 구조만으로 이루어진 강철을 얻을 수 있으며, 이러한 펄라이트 구조는 기계적 특성, 특히 인장 강도 등에서 우수합니다. 상태도에서 보였듯이 철 내의 탄소 함유량에 따라 다양한 상과 구조들이 만들어지며, 기계적인 특성들도 달라져서 연성에서 취성까지, 그리고 강도와 경도를 조절하면서 각각의 용도에 맞는 강철을 얻을 수 있죠.

철의 치명적인 약점은 녹이 스는 것입니다. 즉, 산소나 습기를 만나게 되면 전기화학적인 반응을 통하여 산화철(iron oxide)과 수산화물(hydroxide)을 생성하죠. 물론 이러한 전기화학 반응이 인류에 매우 큰 유용성을 선물한 전지(battery)로 발전하였습니다만. 구조재로 사용할 경우, 녹이 슬고 녹슨 부분이 점점 커져가는 것은 매우 치명적인 문제가 됩니다. 녹이 슬지 않는 강철이 스테인레스강(stainless steel)입니다. 사실 화학적인 녹의 의미, 즉 '금속 원자가 산소와 반응하여 발생하는 금속 산화물'로 따진다면 녹이 슬지 않는 것이 아니라 녹이 빠른 속도로 만들어지는 것이죠. 첨가된 크롬이 철보다 더 신속하게 산소와 반응하여 크롬 산화믈을 형성하여 강철의 표면을 코팅, 산소와 철 원자들간의 접촉을 막는 원리입니다. 철 안에서 크롬이 이러한 역할을 하려면 최소 12wt% 이상의 함량을 필요로 하며, 스테인레스강에서의 크롬 함유량은 12~30wt%의 범위이나 일반적으로는 16~22wt% 정도를 많이 씁니다. 크롬의 함유량이 올라가면 취성에 가까워져서 성형 가공 등이 어렵게 됩니다. 스테인레스강의 사용 온도에 따라 크롬 함유량을 조절하기도 합니다.

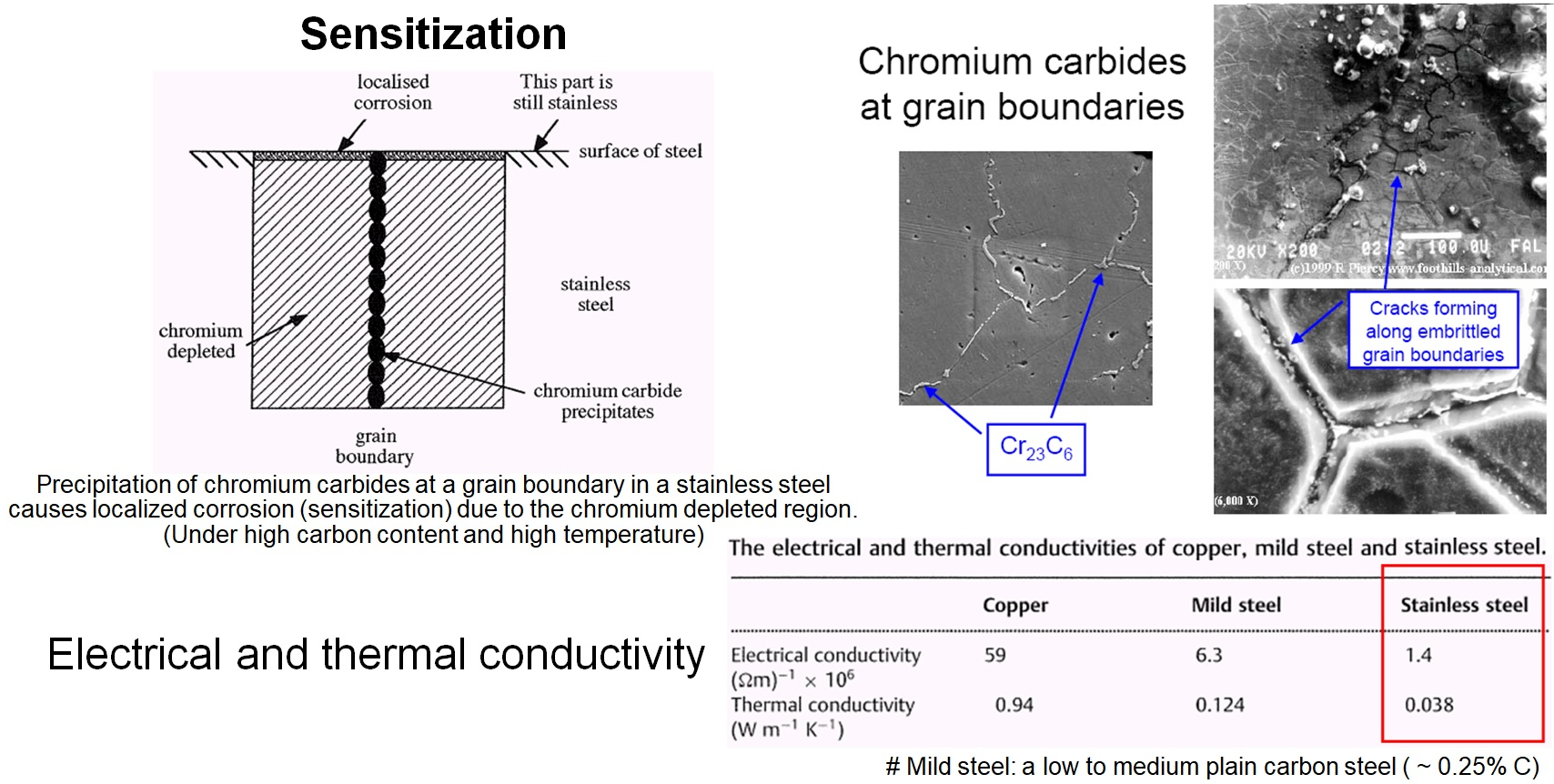
스테인레스강의 예민화(sensitization) 과정도 주의를 하여야 합니다. 즉, 열처리나 용접 과정 등으로 열의 영향을 받은 입계(grain boundry)에서는 크롬 탄화물(chromiun carbide)이 석출이 보다 활발해지고, 이로 인하여 입계 주위에서 크롬의 부족 현상이 일어나게 되죠. 따라서, 크롬 부족으로 내식성이 떨어져 입계를 중심으로 부식이 번져가는 문제가 생깁니다. 이러한 현상을 방지하기 위하여 크롬에 비해 탄화물 형성을 보다 잘하는 티타늄이나 니오비움 등을 추가로 첨가하기도 합니다. 또한 스테인레스강이 구리나 혹은 연철 등에 비하여 전기 전도도와 열 전도도가 많이 낮다는 점도 사용할 때 고려하여야 할 점들입니다.
# 참고로 하고 있는 여러 자료의 도움에 감사를 표하며, 계속 업그레이드 됩니다.
# 의견과 조언, 수정과 요청은 늘 환영합니다. 댓글이나 전자메일로~ bkju@korea.ac.kr
# 저작자, 본 사이트를 반드시 표시, 비영리적으로만 사용할 수 있고, 내용 변경은 금지합니다.
풀어보기


더! 공부하기
'공부와 생각들 > 전자재료 소자' 카테고리의 다른 글
| 1-21. 세라믹, Silicate (0) | 2020.01.07 |
|---|---|
| 1-20. 세라믹 (0) | 2020.01.07 |
| 1-18. 합금, 상태도 (0) | 2020.01.07 |
| 1-17. 금속 성형 (0) | 2020.01.07 |
| 1-16. 기계적 특성, 측정 (0) | 2020.01.07 |